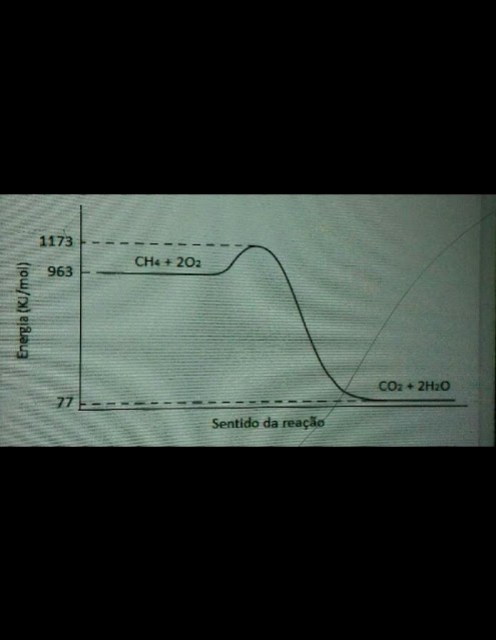
O metano, um hidrocarboneto, é um gás incolor e
pouco solúvel em água. Uma das principais fontes
de metano são os campos de extração de
petróleo. Misturado com o ar, transforma-se em
uma mistura altamente inflamável, cuja queima
completa libera cerca de 1173 kJ/mol de energia.
O gráfico a seguir representa o caminho da reação
de queima completa do gás metano. Com base
neste gráfico, determine a energia de ativação da
reação e a variação de entalpia do processo
global, assinalando a resposta correta a seguir.
a) Ea = 210kJ/mol; AH = -886kJ/mol
b) Ea = -1080kJ/mol; AH = -886kJ/mol
c) Ea = -210kJ/mol; AH = 886kJ/mol
d) Ea = -1096kJ/mol, AH = 1096kJ/mol
e) Ea = 1096kJ/mol; AH = 886kJ/mol
Respostas
1)
A energia de ativação é 210 kJ/mol e a entalpia da reação é -886 kJ/mol (opção A).
O diagrama mencionado no estudo da termodinâmica das reações químicas é muito comum. O eixo y representa a energia e o eixo x representa o progresso da reação ao longo do tempo.
Podemos ver que o composto ativo tem uma energia inicial de 963 kJ/mol e um reagente com uma energia de 1173 kJ/mol. Portanto, a energia de ativação para esta reação é
1,173-963 = 210 kJ/mol
Também podemos ver que a energia do produto é 77 kJ/mol, essa energia é derivada da entalpia da reação
77-963 = –886 kg/mol
2)
Resposta:
Explicação:
questão C